Dukuritë dhe proceset natyrore rreth nesh janë mjaft komplekse. Për përshkrimin e saktë fizik të tyre, duhet të përdoret një aparat matematikor i rëndë dhe të merren parasysh një numër i madh faktorësh domethënës. Për të shmangur këtë problem, në fizikë përdoren disa modele të thjeshtuara, të cilat lehtësojnë shumë analizën matematikore të procesit, por praktikisht nuk ndikojnë në saktësinë e përshkrimit të tij. Një prej tyre është modeli ideal i gazit. Le ta shqyrtojmë më në detaje në artikull.
Koncepti i një gazi ideal
Një gaz ideal është një gjendje grumbullimi i një substance, e cila përbëhet nga pika materiale që nuk ndërveprojnë me njëra-tjetrën. Le ta shpjegojmë këtë përkufizim në më shumë detaje.
Së pari, ne po flasim për pikat materiale si objekte që përbëjnë një gaz ideal. Kjo do të thotë se molekulat dhe atomet e tij nuk kanë një madhësi, por kanë një masë të caktuar. Është e guximshmemund të bëhet një përafrim duke marrë parasysh faktin se në të gjitha gazet reale në presione të ulëta dhe temperatura të larta, distanca ndërmjet molekulave është shumë më e madhe se dimensionet e tyre lineare.
Së dyti, molekulat në një gaz ideal nuk duhet të ndërveprojnë me njëra-tjetrën. Në realitet, ndërveprime të tilla ekzistojnë gjithmonë. Pra, edhe atomet e gazeve fisnike përjetojnë tërheqje dipol-dipol. Me fjalë të tjera, ndërveprimet van der Waals janë të pranishme. Sidoqoftë, krahasuar me energjinë kinetike të rrotullimit dhe lëvizjes përkthimore të molekulave, këto ndërveprime janë aq të vogla sa nuk ndikojnë në vetitë e gazeve. Prandaj, ato nuk mund të merren parasysh gjatë zgjidhjes së problemeve praktike.
Është e rëndësishme të theksohet se jo të gjithë gazrat në të cilët dendësia është e ulët dhe temperatura është e lartë mund të konsiderohen ideale. Përveç ndërveprimeve të van der Waals-it, ka lloje të tjera, më të forta lidhjesh, për shembull, lidhje hidrogjenore midis molekulave H2O, të cilat çojnë në një shkelje të rëndë të kushteve të idealitetit të gazit. Për këtë arsye, avulli i ujit nuk është një gaz ideal, por ajri është.
Modeli fizik i një gazi ideal
Ky model mund të përfaqësohet si më poshtë: supozojmë se sistemi i gazit përmban N grimca. Këto mund të jenë atome dhe molekula të kimikateve dhe elementeve të ndryshme. Numri i grimcave N është i madh, kështu që zakonisht përdoret njësia "mole" për ta përshkruar atë (1 mol korrespondon me numrin e Avogadro-s). Të gjitha lëvizin në një vëllim V. Lëvizjet e grimcavejanë kaotike dhe të pavarura nga njëra-tjetra. Secila prej tyre ka një shpejtësi të caktuar v dhe lëviz përgjatë një rruge të drejtë.
Teorikisht, probabiliteti i përplasjes midis grimcave është pothuajse zero, pasi madhësia e tyre është e vogël në krahasim me distancat ndër grimca. Sidoqoftë, nëse ndodh një përplasje e tillë, atëherë ajo është absolutisht elastike. Në rastin e fundit, momenti total i grimcave dhe energjia e tyre kinetike ruhen.
Modeli i konsideruar i gazeve ideale është një sistem klasik me një numër të madh elementësh. Prandaj, shpejtësia dhe energjia e grimcave në të i binden shpërndarjes statistikore të Maxwell-Boltzmann. Disa grimca kanë shpejtësi të ulët, ndërsa të tjera kanë shpejtësi të lartë. Në këtë rast, ekziston një kufi i caktuar i ngushtë i shpejtësisë, në të cilin qëndrojnë vlerat më të mundshme të kësaj sasie. Shpërndarja e shpejtësisë së molekulave të azotit tregohet skematikisht më poshtë.
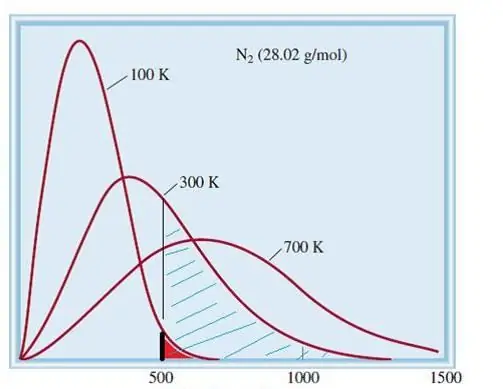
Teoria kinetike e gazeve
Modeli i gazeve ideale i përshkruar më sipër përcakton në mënyrë unike vetitë e gazeve. Ky model u propozua për herë të parë nga Daniel Bernoulli në 1738.

Më pas, ajo u zhvillua në gjendjen e saj aktuale nga August Kroenig, Rudolf Clausius, Mikhail Lomonosov, James Maxwell, Ludwig Boltzmann, Marian Smoluchowski dhe shkencëtarë të tjerë.
Teoria kinetike e substancave fluide, mbi bazën e së cilës është ndërtuar modeli ideal i gazit, shpjegon dy veti të rëndësishme makroskopike të sistemit bazuar në sjelljen e tij mikroskopike:
- Presioni në gazra është rezultat i përplasjes së grimcave me muret e enës.
- Temperatura në sistem është rezultat i manifestimit të lëvizjes së vazhdueshme të molekulave dhe atomeve.
Le të zgjerojmë të dy përfundimet e teorisë kinetike.
Presioni i gazit
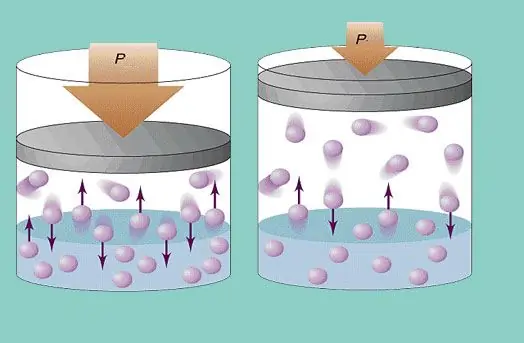
Modeli ideal i gazit supozon një lëvizje të vazhdueshme kaotike të grimcave në sistem dhe përplasjen e tyre të vazhdueshme me muret e enës. Çdo përplasje e tillë konsiderohet absolutisht elastike. Masa e grimcave është e vogël (≈10-27-10-25 kg). Prandaj, nuk mund të krijojë shumë presion në një përplasje. Megjithatë, numri i grimcave, dhe si rrjedhim numri i përplasjeve, është i madh (≈1023). Për më tepër, shpejtësia mesatare katrore e elementeve është disa qindra metra në sekondë në temperaturën e dhomës. E gjithë kjo çon në krijimin e një presioni të dukshëm në muret e anijes. Mund të llogaritet duke përdorur formulën e mëposhtme:
P=Nmvcp2 / (3V), ku vcp është shpejtësia mesatare katrore, m është masa e grimcave.
Temperatura absolute
Sipas modelit ideal të gazit, temperatura përcaktohet në mënyrë unike nga energjia mesatare kinetike e një molekule ose atomi në sistemin në studim. Ju mund të shkruani shprehjen e mëposhtme që lidh energjinë kinetike dhe temperaturën absolute për një gaz ideal:
mvcp2 / 2=3 / 2kB T.
Këtu kB është konstanta Boltzmann. Nga kjo barazi marrim:
T=m vcp2 / (3kB).
Ekuacioni universal i gjendjes
Nëse kombinojmë shprehjet e mësipërme për presionin absolut P dhe temperaturën absolute T, mund të shkruajmë barazinë e mëposhtme:
PV=nRT.
Këtu n është sasia e substancës në mol, R është konstanta e gazit e prezantuar nga D. I. Mendeleev. Kjo shprehje është ekuacioni më i rëndësishëm në teorinë e gazeve ideale, sepse kombinon tre parametra termodinamikë (V, P, T) dhe nuk varet nga karakteristikat kimike të sistemit të gazit.

Ekuacioni universal u nxor për herë të parë eksperimentalisht nga fizikani francez Emile Clapeyron në shekullin e 19-të dhe më pas u soll në formën e tij moderne nga kimisti rus Mendeleev, kjo është arsyeja pse aktualisht mban emrat e këtyre shkencëtarëve.






