Një nga pyetjet e rëndësishme në studimin e sistemeve termodinamike në fizikë është pyetja nëse ky sistem mund të kryejë ndonjë punë të dobishme. I lidhur ngushtë me konceptin e punës është koncepti i energjisë së brendshme. Në këtë artikull, ne do të shqyrtojmë se çfarë është energjia e brendshme e një gazi ideal dhe do të japim formula për llogaritjen e saj.
Gaz ideal
Për gazin, si gjendje grumbullimi, i cili nuk ka asnjë forcë elastike nën ndikimin e jashtëm mbi të dhe, si rrjedhojë, nuk ruan vëllimin dhe formën, e di çdo nxënës. Koncepti i një gazi ideal për shumë mbetet i pakuptueshëm dhe i paqartë. Le ta shpjegojmë.
Një gaz ideal është çdo gaz që plotëson dy kushtet e mëposhtme të rëndësishme:
- Grimcat që e përbëjnë atë nuk kanë madhësi. Ata kanë një madhësi, por është aq e vogël në krahasim me distancat midis tyre sa mund të shpërfillet në të gjitha llogaritjet matematikore.
- Grimcat nuk ndërveprojnë me njëra-tjetrën duke përdorur forcat ose forcat van der Waalsnatyrë tjetër. Në fakt, në të gjithë gazrat realë, një ndërveprim i tillë është i pranishëm, por energjia e tij është e papërfillshme në krahasim me energjinë mesatare të grimcave kinetike.
Kushtet e përshkruara plotësohen nga pothuajse të gjithë gazrat realë, temperaturat e të cilave janë mbi 300 K dhe presionet nuk e kalojnë një atmosferë. Për presione shumë të larta dhe temperatura të ulëta vërehet devijimi i gazeve nga sjellja ideale. Në këtë rast, flitet për gaze reale. Ato përshkruhen nga ekuacioni van der Waals.
Koncepti i energjisë së brendshme të një gazi ideal
Në përputhje me përkufizimin, energjia e brendshme e një sistemi është shuma e energjive kinetike dhe potenciale që përmban ky sistem. Nëse ky koncept zbatohet për një gaz ideal, atëherë përbërësi i mundshëm duhet të hidhet poshtë. Në të vërtetë, duke qenë se grimcat e një gazi ideal nuk ndërveprojnë me njëra-tjetrën, ato mund të konsiderohen se lëvizin lirshëm në vakum absolut. Për të nxjerrë një grimcë nga sistemi në studim, nuk është e nevojshme të punohet kundër forcave të brendshme të ndërveprimit, pasi këto forca nuk ekzistojnë.
Kështu, energjia e brendshme e një gazi ideal përkon gjithmonë me energjinë e tij kinetike. Kjo e fundit, nga ana tjetër, përcaktohet në mënyrë unike nga masa molare e grimcave të sistemit, numri i tyre, si dhe shpejtësia mesatare e lëvizjes përkthimore dhe rrotulluese. Shpejtësia e lëvizjes varet nga temperatura. Një rritje e temperaturës çon në një rritje të energjisë së brendshme dhe anasjelltas.
Formula përenergjia e brendshme
Shënoni energjinë e brendshme të një sistemi gazi ideal me shkronjën U. Sipas termodinamikës, ajo përkufizohet si diferenca midis entalpisë H të sistemit dhe produktit të presionit dhe vëllimit, që është:
U=H - pV.
Në paragrafin e mësipërm, zbuluam se vlera e U korrespondon me energjinë totale kinetike Ektë të gjitha grimcave të gazit:
U=Ek.
Nga mekanika statistikore, në kuadrin e teorisë kinetike molekulare (MKT) të një gazi ideal, rezulton se energjia mesatare kinetike e një grimce Ek1 është e barabartë me vlera e mëposhtme:
Ek1=z/2kBT.
Këtu kB dhe T - konstanta dhe temperatura e Boltzmann, z - numri i shkallëve të lirisë. Energjia totale kinetike e sistemit Ek mund të merret duke shumëzuar Ek1 me numrin e grimcave N në sistem:
Ek=NEk1=z/2NkBT.
Kështu, kemi marrë formulën për energjinë e brendshme të një gazi ideal, të shkruar në formë të përgjithshme në termat e temperaturës absolute dhe numrit të grimcave në një sistem të mbyllur:
U=z/2NkBT.
Gaz monotomik dhe poliatomik
Formula për U e shkruar në paragrafin e mëparshëm të artikullit është e papërshtatshme për përdorimin e saj praktik, pasi është e vështirë të përcaktohet numri i grimcave N. Sidoqoftë, nëse marrim parasysh përkufizimin e sasisë së substancës n, atëherë kjo shprehje mund të rishkruhet në një formë më të përshtatshme:
n=N/NA; R=NAkB=8, 314 J/(molK);
U=z/2nR T.
Numri i shkallëve të lirisë z varet nga gjeometria e grimcave që përbëjnë gazin. Kështu, për një gaz monoatomik, z=3, pasi një atom mund të lëvizë në mënyrë të pavarur vetëm në tre drejtime të hapësirës. Nëse gazi është diatomik, atëherë z=5, pasi tre shkallëve të lirisë përkthimore i shtohen edhe dy shkallë të lirisë rrotulluese. Së fundi, për çdo gaz tjetër poliatomik, z=6 (3 shkallë lirie përkthimore dhe 3 rrotulluese). Duke pasur parasysh këtë, ne mund të shkruajmë në formën e mëposhtme formulat për energjinë e brendshme të një gazi ideal monatomik, diatomik dhe poliatomik:
U1=3/2nRT;
U2=5/2nRT;
U≧3=3nRT.
Shembull i një detyre për të përcaktuar energjinë e brendshme
Një cilindër 100 litra përmban hidrogjen të pastër në një presion prej 3 atmosferash. Duke supozuar se hidrogjeni është një gaz ideal në kushte të caktuara, është e nevojshme të përcaktohet se cila është energjia e tij e brendshme.

Formulat e mësipërme për U përmbajnë sasinë e substancës dhe temperaturën e gazit. Në gjendjen e problemit nuk thuhet absolutisht asgjë për këto sasi. Për të zgjidhur problemin, është e nevojshme të kujtojmë ekuacionin universal Clapeyron-Mendeleev. Ajo ka pamjen e treguar në figurë.
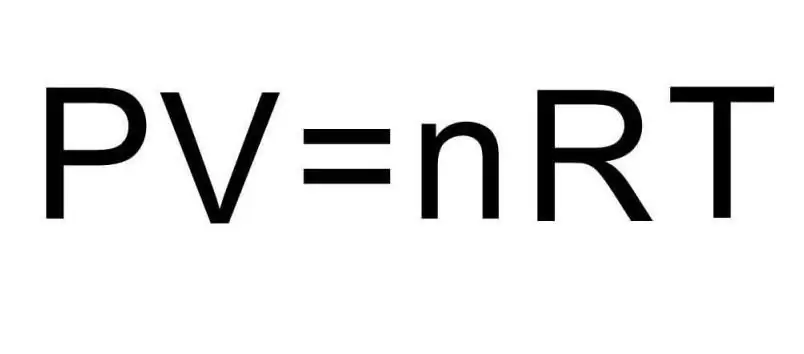
Meqenëse hidrogjeni H2 është një molekulë diatomike, formula për energjinë e brendshme është:
UH2=5/2nRT.
Duke krahasuar të dyja shprehjet, arrijmë në formulën përfundimtare për zgjidhjen e problemit:
UH2=5/2PV.
Mbetet të konvertohen njësitë e presionit dhe vëllimit nga gjendja në sistemin SI të njësive, të zëvendësohen vlerat përkatëse në formulën për UH2 dhe të merret përgjigje: UH2 ≈ 76 kJ.






