Gazi ideal, ekuacioni i gjendjes së gazit ideal, temperatura dhe presioni i tij, vëllimi… lista e parametrave dhe përkufizimeve të përdorura në seksionin përkatës të fizikës mund të vazhdohet për një kohë mjaft të gjatë. Sot do të flasim vetëm për këtë temë.
Çfarë konsiderohet në fizikën molekulare?

Objekti kryesor i konsideruar në këtë seksion është një gaz ideal. Ekuacioni ideal i gjendjes së gazit u mor duke marrë parasysh kushtet normale mjedisore, dhe ne do të flasim për këtë pak më vonë. Tani le t'i qasemi këtij "problemi" nga larg.
Le të themi se kemi një masë gazi. Gjendja e tij mund të përcaktohet duke përdorur tre parametra të një natyre termodinamike. Këto janë, natyrisht, presioni, vëllimi dhe temperatura. Ekuacioni i gjendjes së sistemit në këtë rast do të jetë formula për marrëdhënien midis parametrave përkatës. Duket kështu: F (p, V, T)=0.
Këtu, për herë të parë, ne po i afrohemi dalëngadalë shfaqjes së një gjëje të tillë si idealegazit. Quhet gaz në të cilin ndërveprimet ndërmjet molekulave janë të papërfillshme. Në përgjithësi, kjo nuk ekziston në natyrë. Sidoqoftë, çdo gaz shumë i rrallë është afër tij. Azoti, oksigjeni dhe ajri, të cilat janë në kushte normale, ndryshojnë pak nga idealja. Për të shkruar ekuacionin e gjendjes për një gaz ideal, mund të përdorim ligjin e unifikuar të gazit. Ne marrim: pV/T=konst.
Koncepti i ngjashëm 1: Ligji i Avogadros
Ai mund të na thotë se nëse marrim të njëjtin numër molesh të çdo gazi absolutisht të rastësishëm dhe i vendosim në të njëjtat kushte, duke përfshirë temperaturën dhe presionin, atëherë gazrat do të zënë të njëjtin vëllim. Në veçanti, eksperimenti u krye në kushte normale. Kjo do të thotë se temperatura ishte 273,15 Kelvin, presioni ishte një atmosferë (760 milimetra merkur, ose 101325 Pascals). Me këto parametra, gazi zinte një vëllim të barabartë me 22.4 litra. Prandaj, mund të themi se për një mol të çdo gazi, raporti i parametrave numerikë do të jetë një vlerë konstante. Kjo është arsyeja pse u vendos që kjo shifër të caktohet me shkronjën R dhe të quhet konstanta universale e gazit. Kështu, është e barabartë me 8.31. Njësia është J/molK.
Gaz ideal. Ekuacioni ideal i gjendjes së gazit dhe manipulimi i tij
Le të përpiqemi të rishkruajmë formulën. Për ta bërë këtë, ne e shkruajmë atë në këtë formë: pV=RT. Tjetra, ne kryejmë një veprim të thjeshtë, shumëzojmë të dy anët e ekuacionit me një numër arbitrar molesh. Ne marrim pVu=uRT. Le të marrim parasysh faktin se produkti i vëllimit molar dhesasia e materies është thjesht vëllimi. Por në fund të fundit, numri i nishaneve do të jetë njëkohësisht i barabartë me koeficientin e masës dhe masës molare. Kjo është pikërisht ajo që duket ekuacioni Mendeleev-Clapeyron. Ai jep një ide të qartë se çfarë lloj sistemi formon një gaz ideal. Ekuacioni i gjendjes për një gaz ideal do të marrë formën: pV=mRT/M.
Nxjerrë formulën për presionin
Le të bëjmë edhe disa manipulime me shprehjet e marra. Për ta bërë këtë, ana e djathtë e ekuacionit Mendeleev-Clapeyron shumëzohet dhe pjesëtohet me numrin Avogadro. Tani shikojmë me kujdes produktin e sasisë së substancës me numrin Avogadro. Ky nuk është gjë tjetër veçse numri i përgjithshëm i molekulave në gaz. Por në të njëjtën kohë, raporti i konstantës universale të gazit me numrin Avogadro do të jetë i barabartë me konstantën Boltzmann. Prandaj, formulat për presionin mund të shkruhen si më poshtë: p=NkT/V ose p=nkT. Këtu simboli n është përqendrimi i grimcave.
Proceset ideale të gazit
Në fizikën molekulare ekziston një gjë e tillë si izoproceset. Këto janë procese termodinamike që ndodhin në sistem në një nga parametrat konstant. Në këtë rast, masa e substancës gjithashtu duhet të mbetet konstante. Le t'i shohim ato më konkretisht. Pra, ligjet e një gazi ideal.
Presioni qëndron konstant
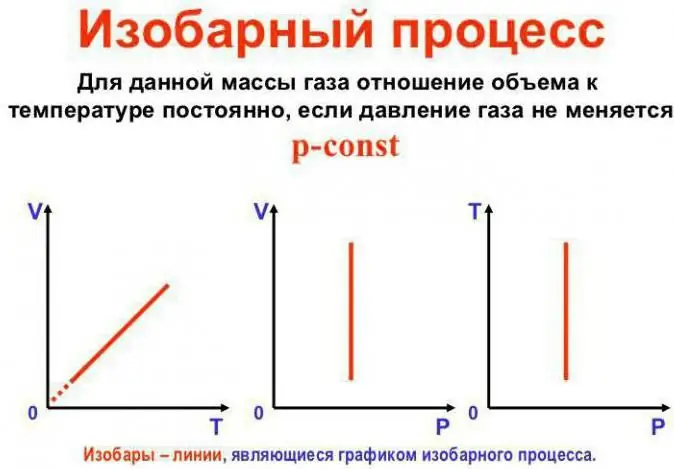
Ky është ligji i Gay-Lussac. Duket kështu: V/T=konst. Mund të rishkruhet në një mënyrë tjetër: V=Vo (1 + at). Këtu a është e barabartë me 1/273.15 K^-1 dhe quhet "koeficienti i zgjerimit të vëllimit". Ne mund ta zëvendësojmë temperaturën si në Celsius ashtu edhe nëshkalla Kelvin. Në rastin e fundit, marrim formulën V=Voat.
Vëllimi qëndron konstant

Ky është ligji i dytë i Gay-Lussac, i referuar më shpesh si ligji i Charles. Duket kështu: p/T=konst. Ekziston një formulim tjetër: p=po (1 + at). Transformimet mund të kryhen në përputhje me shembullin e mëparshëm. Siç mund ta shihni, ligjet ideale të gazit ndonjëherë janë mjaft të ngjashme me njëri-tjetrin.
Temperatura qëndron konstante

Nëse temperatura e një gazi ideal mbetet konstante, atëherë mund të marrim ligjin Boyle-Mariotte. Mund të shkruhet kështu: pV=konst.
Koncepti i ngjashëm 2: Presioni i pjesshëm
Le të themi se kemi një enë me gazra. Do të jetë një përzierje. Sistemi është në një gjendje ekuilibri termik dhe vetë gazrat nuk reagojnë me njëri-tjetrin. Këtu N do të shënojë numrin e përgjithshëm të molekulave. N1, N2 dhe kështu me radhë, përkatësisht, numri i molekulave në secilin nga përbërësit e përzierjes. Le të marrim formulën e presionit p=nkT=NkT/V. Mund të hapet për një rast specifik. Për një përzierje me dy përbërës, formula do të marrë formën: p=(N1 + N2) kT/V. Por më pas rezulton se presioni total do të përmblidhet nga presionet e pjesshme të secilës përzierje. Pra, do të duket si p1 + p2 e kështu me radhë. Këto do të jenë presionet e pjesshme.
Për çfarë është?
Formula që kemi marrë tregon se presioni në sistem është nga secili grup molekulash. Rastësisht, nuk varet ngatë tjerët. D altoni përfitoi nga kjo kur formuloi ligjin, i quajtur më vonë pas tij: në një përzierje ku gazrat nuk reagojnë kimikisht me njëri-tjetrin, presioni total do të jetë i barabartë me shumën e presioneve të pjesshme.






