Çdo njeri gjatë jetës së tij ndeshet me trupa që janë në një nga tre gjendjet e përgjithshme të materies. Gjendja më e thjeshtë e grumbullimit për t'u studiuar është gazi. Në artikull do të shqyrtojmë konceptin e një gazi ideal, do të japim ekuacionin e gjendjes së sistemit dhe gjithashtu do t'i kushtojmë vëmendje përshkrimit të temperaturës absolute.
Gjendja e gazit e materies
Çdo student e ka një ide të mirë se për çfarë gjendjeje lënde po flet kur dëgjon fjalën "gaz". Kjo fjalë kuptohet si një trup që është në gjendje të zërë çdo vëllim që i jepet. Nuk është në gjendje të mbajë formën e saj, sepse nuk mund t'i rezistojë as ndikimit më të vogël të jashtëm. Gjithashtu, gazi nuk ruan vëllim, gjë që e dallon atë jo vetëm nga trupat e ngurtë, por edhe nga lëngjet.
Ashtu si një lëng, një gaz është një substancë e lëngshme. Në procesin e lëvizjes së trupave të ngurtë në gaze, këto të fundit e pengojnë këtë lëvizje. Forca që rezulton quhet rezistencë. Vlera e saj varet ngashpejtësia e trupit në gaz.
Shembuj të fortë të gazrave janë ajri, gazi natyror që përdoret për ngrohjen e shtëpive dhe gatimin, gazrat inerte (Ne, Ar) të përdorura për të mbushur tubat e ndriçimit të reklamave ose përdoren për të krijuar një mjedis inert (jo agresiv, mbrojtës) gjatë saldimit.
Gaz ideal
Para se të vazhdoni me përshkrimin e ligjeve të gazit dhe ekuacionit të gjendjes, duhet të kuptoni mirë pyetjen se çfarë është një gaz ideal. Ky koncept është futur në teorinë kinetike molekulare (MKT). Një gaz ideal është çdo gaz që plotëson karakteristikat e mëposhtme:
- Grimcat që e formojnë atë nuk ndërveprojnë me njëra-tjetrën përveç përplasjeve të drejtpërdrejta mekanike.
- Si rezultat i përplasjes së grimcave me muret e enës ose ndërmjet tyre, energjia e tyre kinetike dhe momenti ruhen, domethënë përplasja konsiderohet absolutisht elastike.
- Grimcat nuk kanë dimensione, por kanë një masë të fundme, domethënë janë të ngjashme me pikat materiale.
Është e natyrshme që çdo gaz nuk është ideal, por real. Megjithatë, për zgjidhjen e shumë problemeve praktike, këto përafrime janë mjaft të vlefshme dhe mund të përdoren. Ekziston një rregull i përgjithshëm empirik që thotë: pavarësisht nga natyra kimike, nëse një gaz ka një temperaturë mbi temperaturën e dhomës dhe një presion të rendit atmosferik ose më të ulët, atëherë ai mund të konsiderohet ideal me saktësi të lartë dhe mund të përdoret për të përshkruar atë.formula e ekuacionit të gjendjes së gazit ideal.
Ligji Clapeyron-Mendeleev
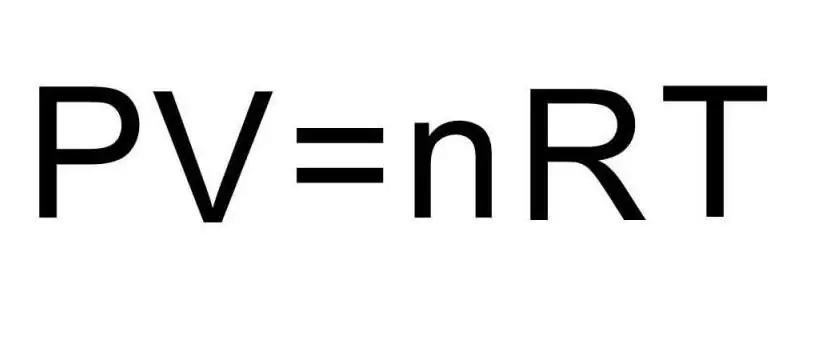
Tranzicionet ndërmjet gjendjeve të ndryshme agregate të materies dhe proceseve brenda një gjendje të vetme agregate trajtohen nga termodinamika. Presioni, temperatura dhe vëllimi janë tre sasi që përcaktojnë në mënyrë unike çdo gjendje të një sistemi termodinamik. Formula për ekuacionin e gjendjes së një gazi ideal kombinon të tre këto sasi në një barazi të vetme. Le të shkruajmë këtë formulë:
PV=nRT
Këtu P, V, T - presioni, vëllimi, temperatura, përkatësisht. Vlera e n është sasia e substancës në mol, dhe simboli R tregon konstantën universale të gazeve. Kjo barazi tregon se sa më i madh të jetë produkti i presionit dhe vëllimit, aq më i madh duhet të jetë produkti i sasisë së substancës dhe temperaturës.

Formula për ekuacionin e gjendjes së një gazi quhet ligji Clapeyron-Mendeleev. Në 1834, shkencëtari francez Emile Clapeyron, duke përmbledhur rezultatet eksperimentale të paraardhësve të tij, erdhi në këtë ekuacion. Sidoqoftë, Clapeyron përdori një numër konstante, të cilat Mendeleev më vonë i zëvendësoi me një - konstanten universale të gazit R (8, 314 J / (molK)). Prandaj, në fizikën moderne, ky ekuacion është emëruar sipas emrave të shkencëtarëve francezë dhe rusë.

Forma të tjera të ekuacionit
Më sipër, kemi shkruar ekuacionin e gjendjes Mendeleev-Clapeyron për një gaz ideal në përgjithësisht të pranuar dheformë e përshtatshme. Megjithatë, në problemet në termodinamikë, shpesh mund të kërkohet një formë paksa e ndryshme. Tre formula të tjera janë shkruar më poshtë, të cilat rrjedhin drejtpërdrejt nga ekuacioni i shkruar:
PV=NkBT;
PV=m/MRT;
P=ρRT/M.
Këto tre ekuacione janë gjithashtu universale për një gaz ideal, vetëm në to shfaqen sasi të tilla si masa m, masa molare M, dendësia ρ dhe numri i grimcave N që përbëjnë sistemin. Simboli kB këtu tregon konstantën Boltzmann (1, 3810-23J/K).
Ligji Boyle-Mariotte
Kur Clapeyron përpiloi ekuacionin e tij, ai bazohej në ligjet e gazit që ishin zbuluar eksperimentalisht disa dekada më parë. Një prej tyre është ligji Boyle-Mariotte. Ai pasqyron një proces izotermik në një sistem të mbyllur, si rezultat i të cilit ndryshojnë parametra të tillë makroskopikë si presioni dhe vëllimi. Nëse vendosim T dhe n konstante në ekuacionin e gjendjes për një gaz ideal, atëherë ligji i gazit do të marrë formën:
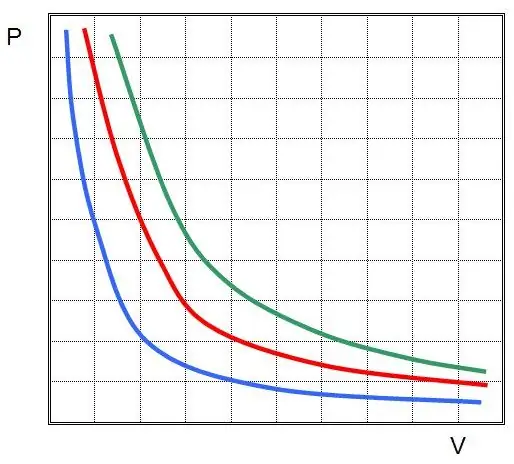
P1V1=P2V 2
Ky është ligji Boyle-Mariotte, i cili thotë se produkti i presionit dhe vëllimit ruhet gjatë një procesi izotermik arbitrar. Në këtë rast, vetë vlerat P dhe V ndryshojnë.
Nëse vizatoni P(V) ose V(P), atëherë izotermat do të jenë hiperbola.
Ligjet e Charles dhe Gay-Lussac
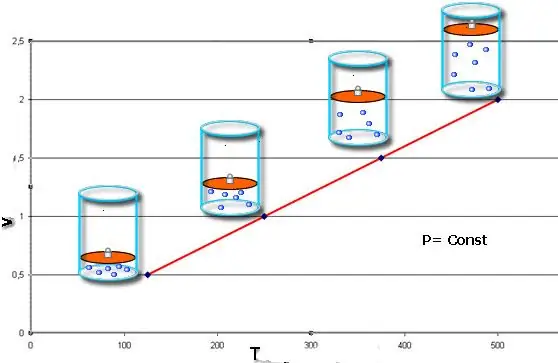
Këto ligje përshkruajnë matematikisht izobarik dhe izokorikprocese, domethënë kalime të tilla midis gjendjeve të sistemit të gazit, në të cilat ruhen respektivisht presioni dhe vëllimi. Ligji i Charles mund të shkruhet matematikisht si më poshtë:
V/T=konstacion kur n, P=konst.
Ligji i Gay-Lussac është shkruar si më poshtë:
P/T=konst kur n, V=konst.
Nëse të dyja barazitë paraqiten në formën e një grafiku, atëherë do të marrim drejtëza që janë të prirura në një kënd me boshtin x. Ky lloj grafiku tregon një proporcion të drejtpërdrejtë midis vëllimit dhe temperaturës në presion konstant dhe midis presionit dhe temperaturës në vëllim konstant.
Vini re se të tre ligjet e konsideruara të gazit nuk marrin parasysh përbërjen kimike të gazit, si dhe ndryshimin në sasinë e tij të materies.
Temperatura absolute
Në jetën e përditshme, ne jemi mësuar të përdorim shkallën e temperaturës Celsius, pasi është e përshtatshme për të përshkruar proceset rreth nesh. Pra, uji vlon në 100 oC dhe ngrin në 0 oC. Në fizikë, kjo shkallë rezulton të jetë e papërshtatshme, prandaj, përdoret e ashtuquajtura shkalla e temperaturës absolute, e cila u prezantua nga Lord Kelvin në mesin e shekullit të 19-të. Në përputhje me këtë shkallë, temperatura matet në Kelvin (K).
Besohet se në një temperaturë prej -273, 15 oC nuk ka dridhje termike të atomeve dhe molekulave, lëvizja e tyre përpara ndalon plotësisht. Kjo temperaturë në gradë Celsius korrespondon me zero absolute në Kelvin (0 K). Nga ky përkufizimkuptimi fizik i temperaturës absolute vijon: është një masë e energjisë kinetike të grimcave që përbëjnë lëndën, për shembull, atomet ose molekulat.
Përveç kuptimit fizik të mësipërm të temperaturës absolute, ka qasje të tjera për të kuptuar këtë sasi. Një prej tyre është ligji i gazit i përmendur i Charles. Le ta shkruajmë në formën e mëposhtme:
V1/T1=V2/T 2=>
V1/V2=T1/T 2.
Barazia e fundit thotë se në një sasi të caktuar të substancës në sistem (për shembull, 1 mol) dhe një presion të caktuar (për shembull, 1 Pa), vëllimi i gazit përcakton në mënyrë unike temperaturën absolute. Me fjalë të tjera, një rritje në vëllimin e gazit në këto kushte është e mundur vetëm për shkak të rritjes së temperaturës, dhe një rënie në vëllim tregon një ulje të vlerës së T.
Kujtojmë se, ndryshe nga temperatura Celsius, temperatura absolute nuk mund të jetë negative.
Parimi Avogadro dhe përzierjet e gazit
Përveç ligjeve të mësipërme të gazit, ekuacioni i gjendjes për një gaz ideal çon edhe në parimin e zbuluar nga Amedeo Avogadro në fillim të shekullit të 19-të, i cili mban mbiemrin e tij. Ky parim përcakton se vëllimi i çdo gazi në presion dhe temperaturë konstante përcaktohet nga sasia e substancës në sistem. Formula përkatëse duket kështu:
n/V=konst kur P, T=konst.
Shprehja e shkruar çon në ligjin e njohur në fizikën e gazit ideal të D altonit për përzierjet e gazit. Kjoligji thotë se presioni i pjesshëm i një gazi në një përzierje përcaktohet në mënyrë unike nga fraksioni i tij atomik.
Shembull i zgjidhjes së problemit
Në një enë të mbyllur me mure të ngurtë që përmban një gaz ideal, si rezultat i ngrohjes, presioni u rrit me 3 herë. Është e nevojshme të përcaktohet temperatura përfundimtare e sistemit nëse vlera fillestare e tij ishte 25 oC.
Së pari, le ta kthejmë temperaturën nga gradë Celsius në Kelvin, kemi:
T=25 + 273, 15=298, 15 K.
Meqenëse muret e enës janë të ngurtë, procesi i ngrohjes mund të konsiderohet izokorik. Për këtë rast, ne zbatojmë ligjin Gay-Lussac, kemi:
P1/T1=P2/T 2=>
T2=P2/P1T 1.
Kështu, temperatura përfundimtare përcaktohet nga produkti i raportit të presionit dhe temperaturës fillestare. Duke zëvendësuar të dhënat në barazi, marrim përgjigjen: T2=894,45 K. Kjo temperaturë korrespondon me 621,3 oC.






