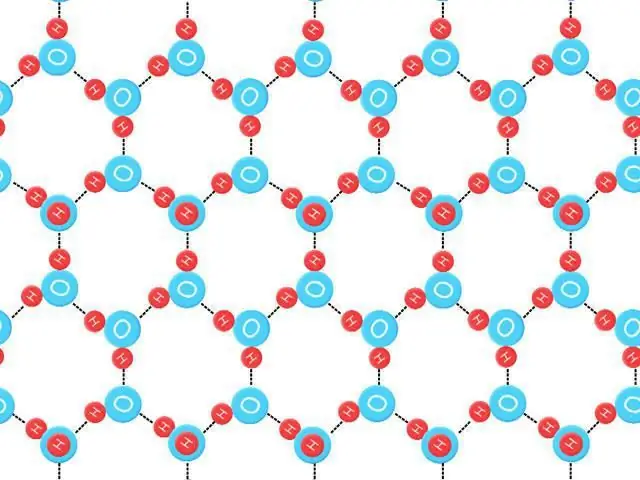
Gjendja tredimensionale e ujit të lëngshëm është e vështirë për t'u studiuar, por shumë është mësuar duke analizuar strukturën e kristaleve të akullit. Katër atomet fqinje të oksigjenit që ndërveprojnë me hidrogjenin zënë kulmet e një tetraedri (tetra=katër, hedron=rrafsh). Energjia mesatare e nevojshme për të thyer një lidhje të tillë në akull është vlerësuar në 23 kJ/mol-1.

Aftësia e molekulave të ujit për të formuar një numër të caktuar zinxhirësh hidrogjeni, si dhe një forcë e caktuar, krijon një pikë shkrirjeje jashtëzakonisht të lartë. Kur shkrihet, mbahet nga uji i lëngshëm, struktura e të cilit është e parregullt. Shumica e lidhjeve hidrogjenore janë të shtrembëruara. Duhet një sasi e madhe energjie në formën e nxehtësisë për të thyer rrjetën kristalore të akullit të lidhur me hidrogjen.
Veçoritë e shfaqjes së akullit (Ih)
Shumë nga banorët po pyesin se çfarë lloj rrjete kristalore ka akulli. E nevojshmeDuhet të theksohet se dendësia e shumicës së substancave rritet gjatë ngrirjes, kur lëvizjet molekulare ngadalësohen dhe formohen kristale të mbushura dendur. Dendësia e ujit gjithashtu rritet ndërsa ftohet në maksimum në 4°C (277K). Më pas, kur temperatura bie nën këtë vlerë, ajo zgjerohet.
Kjo rritje është për shkak të formimit të një kristal akulli të hapur, të lidhur me hidrogjen, me rrjetën e tij dhe densitetin më të ulët, në të cilin secila molekulë uji është e lidhur fort nga elementi i mësipërm dhe katër vlera të tjera, ndërsa lëviz mjaft shpejt për të kanë më shumë masë. Meqenëse ndodh ky veprim, lëngu ngrin nga lart poshtë. Kjo ka rezultate të rëndësishme biologjike, si rezultat i të cilave shtresa e akullit në pellg izolon qeniet e gjalla larg të ftohtit ekstrem. Përveç kësaj, dy veti shtesë të ujit lidhen me karakteristikat e tij të hidrogjenit: nxehtësia specifike dhe avullimi.
Përshkrim i detajuar i strukturave
Kriteri i parë është sasia e nevojshme për të rritur temperaturën e 1 gram të një lënde me 1°C. Ngritja e shkallëve të ujit kërkon një sasi relativisht të madhe nxehtësie sepse çdo molekulë është e përfshirë në lidhje të shumta hidrogjeni që duhet të thyhen në mënyrë që energjia kinetike të rritet. Meqë ra fjala, bollëku i H2O në qelizat dhe indet e të gjithë organizmave të mëdhenj shumëqelizorë do të thotë që luhatjet e temperaturës brenda qelizave janë minimizuar. Kjo veçori është thelbësore, pasi shpejtësia e shumicës së reaksioneve biokimikei ndjeshëm.
Nxehtësia e avullimit të ujit është gjithashtu dukshëm më e lartë se ajo e shumë lëngjeve të tjera. Për shndërrimin e këtij trupi në gaz nevojitet një sasi e madhe nxehtësie, sepse lidhjet hidrogjenore duhet të prishen në mënyrë që molekulat e ujit të shpërndahen nga njëra-tjetra dhe të hyjnë në fazën e përmendur. Trupat e ndryshueshëm janë dipole të përhershme dhe mund të ndërveprojnë me komponime të tjera të ngjashme dhe me ato që jonizohen dhe treten.
Substancat e tjera të përmendura më sipër mund të vijnë në kontakt vetëm nëse ka polaritet. Është kjo përbërje që është e përfshirë në strukturën e këtyre elementeve. Përveç kësaj, ai mund të rreshtohet rreth këtyre grimcave të formuara nga elektrolitet, në mënyrë që atomet negative të oksigjenit të molekulave të ujit të orientohen te kationet, dhe jonet pozitive dhe atomet e hidrogjenit të orientohen te anionet.
Në trupat e ngurtë, si rregull, formohen rrjeta kristalore molekulare dhe ato atomike. Kjo do të thotë, nëse jodi është ndërtuar në atë mënyrë që të përmbajë I2, , atëherë në dioksid karboni të ngurtë, domethënë në akull të thatë, molekula CO2 janë të vendosura në nyjet e rrjetës kristalore . Kur ndërvepron me substanca të ngjashme, akulli ka një rrjetë kristalore jonike. Grafiti, për shembull, i cili ka një strukturë atomike të bazuar në karbon, nuk është në gjendje ta ndryshojë atë, ashtu si diamanti.
Çfarë ndodh kur një kristal i kripës së tryezës tretet në ujë: molekulat polare tërhiqen nga elementët e ngarkuar në kristal, gjë që çon në formimin e grimcave të ngjashme të natriumit dhe klorurit në sipërfaqen e tij, duke rezultuar në këto trupajanë të dislokuara nga njëra-tjetra dhe ajo fillon të shpërndahet. Nga këtu mund të vërehet se akulli ka një rrjetë kristalore me lidhje jonike. Çdo Na + i tretur tërheq skajet negative të disa molekulave të ujit, ndërsa secili Cl i tretur - tërheq skajet pozitive. Predha që rrethon çdo jon quhet sfera e arratisjes dhe zakonisht përmban disa shtresa grimcash tretës.
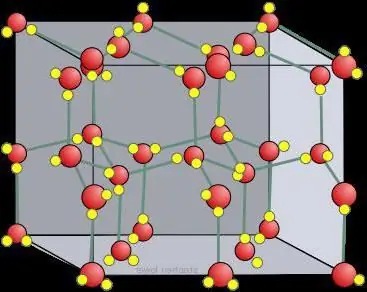
Rrjetë kristalore e akullit të thatë
Ndryshoret ose një jon i rrethuar nga elementë thuhet se janë të sulfatizuar. Kur tretësi është uji, grimcat e tilla hidraten. Kështu, çdo molekulë polare tenton të tretet nga elementët e trupit të lëngshëm. Në akullin e thatë, lloji i rrjetës kristalore formon lidhje atomike në gjendje grumbullimi, të cilat janë të pandryshuara. Një tjetër gjë është akulli kristalor (uji i ngrirë). Komponimet organike jonike si karboksilaza dhe aminat e protonuara duhet të jenë të tretshme në grupe hidroksil dhe karbonil. Grimcat që përmbahen në struktura të tilla lëvizin ndërmjet molekulave dhe sistemet e tyre polare formojnë lidhje hidrogjeni me këtë trup.
Sigurisht, numri i grupeve të fundit të treguara në një molekulë ndikon në tretshmërinë e saj, e cila gjithashtu varet nga reagimi i strukturave të ndryshme në element: për shembull, alkoolet me një, dy dhe tre karbon janë të përzier. me ujë, por hidrokarburet më të mëdha me përbërje të vetme hidroksil janë shumë më pak të holluar në lëngje.
Gjashtëkëndëshi Ih është i ngjashëm në formë merrjetë atomike kristalore. Për akullin dhe gjithë borën natyrore në Tokë, duket saktësisht kështu. Kjo dëshmohet nga simetria e rrjetës kristalore të akullit, e rritur nga avujt e ujit (d.m.th., flokët e borës). Është në grupin hapësinor P 63/mm nga 194; D 6h, klasa Laue 6/mm; e ngjashme me β-, e cila ka një shumëfish prej 6 boshti spirale (rrotullimi rreth, përveç zhvendosjes përgjatë tij). Ka një strukturë mjaft të hapur me densitet të ulët ku efikasiteti është i ulët (~ 1/3) krahasuar me strukturat e thjeshta kubike (~ 1/2) ose në qendër të fytyrës (~ 3/4).
Në krahasim me akullin e zakonshëm, rrjeta kristalore e akullit të thatë, e lidhur nga molekulat CO2, është statike dhe ndryshon vetëm kur atomet prishen.
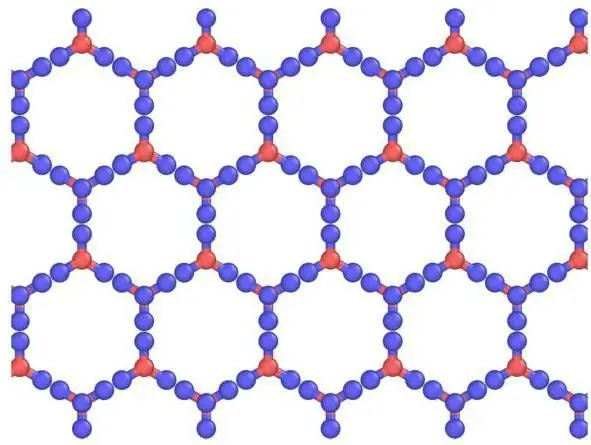
Përshkrimi i grilave dhe elementët e tyre
Kristalet mund të shihen si modele kristalore, të përbëra nga fletë të vendosura njëra mbi tjetrën. Lidhja e hidrogjenit është e renditur, ndërsa në realitet është e rastësishme, pasi protonet mund të lëvizin ndërmjet molekulave të ujit (akullit) në temperatura mbi rreth 5 K. Në të vërtetë, ka të ngjarë që protonet të sillen si një lëng kuantik në një rrjedhë tunele të vazhdueshme. Kjo përmirësohet nga shpërndarja e neutroneve, duke treguar densitetin e tyre të shpërndarjes në gjysmë të rrugës midis atomeve të oksigjenit, duke treguar lokalizimin dhe lëvizjen e bashkërenduar. Këtu ka një ngjashmëri të akullit me një rrjetë kristalore atomike, molekulare.
Molekulat kanë një rregullim të shkallëzuar të zinxhirit të hidrogjenitnë lidhje me tre fqinjët e saj në aeroplan. Elementi i katërt ka një rregullim të lidhjes hidrogjenore të eklipsuar. Ka një devijim të lehtë nga simetria e përsosur gjashtëkëndore, pasi qeliza e njësisë është 0.3% më e shkurtër në drejtim të këtij zinxhiri. Të gjitha molekulat përjetojnë të njëjtat mjedise molekulare. Brenda çdo "kutie" ka hapësirë të mjaftueshme për të mbajtur grimcat e ujit intersticial. Edhe pse nuk konsiderohen përgjithësisht, ato kohët e fundit janë zbuluar në mënyrë efektive nga difraksioni i neutronit të rrjetës kristalore pluhur të akullit.
Ndërrimi i substancave
Trupi gjashtëkëndor ka pika të trefishta me ujë të lëngshëm dhe të gaztë 0,01 ° C, 612 Pa, elementë të ngurtë - tre -21,985 ° C, 209,9 MPa, njëmbëdhjetë dhe dy -199,8 ° C, 70 MPa, si dhe - 34,7 ° C, 212,9 MPa. Konstanta dielektrike e akullit gjashtëkëndor është 97,5.
Kurba e shkrirjes së këtij elementi jepet me MPa. Ekuacionet e gjendjes janë të disponueshme, përveç tyre, disa pabarazi të thjeshta që lidhen me ndryshimin e vetive fizike me temperaturën e akullit gjashtëkëndor dhe pezullimet ujore të tij. Fortësia luhatet me shkallët që rriten nga ose nën gips (≦2) në 0°C në feldspat (6 Mohs) në -80°C, një ndryshim anormalisht i madh në fortësinë absolute (> 24 herë).
Rrjeta kristalore gjashtëkëndore e akullit formon pllaka dhe kolona gjashtëkëndore, ku faqet e sipërme dhe të poshtme janë rrafshet bazale {0 0 0 1} me një entalpi prej 5,57 μJ cm -2, dhe pjesët e tjera anësore ekuivalente quhen pjesë të prizmit {1 0 -1 0} me 5, 94µJ cm -2. Sipërfaqet dytësore {1 1 -2 0} me 6,90 MJ ˣ cm -2 mund të formohen përgjatë rrafsheve të formuara nga anët e strukturave.
Një strukturë e tillë tregon një rënie anormale të përçueshmërisë termike me rritjen e presionit (si dhe akull kub dhe amorf me densitet të ulët), por ndryshon nga shumica e kristaleve. Kjo është për shkak të një ndryshimi në lidhjen e hidrogjenit, i cili redukton shpejtësinë tërthore të zërit në rrjetën kristalore të akullit dhe ujit.
Ekzistojnë metoda që përshkruajnë se si të përgatiten mostra të mëdha kristalesh dhe çdo sipërfaqe akulli të dëshiruar. Supozohet se lidhja hidrogjenore në sipërfaqen e trupit gjashtëkëndor në studim do të jetë më e renditur sesa brenda sistemit të masës. Spektroskopia variacionale me gjenerimin e frekuencës së rrjetës së fazës ka treguar se ekziston një asimetri strukturore midis dy shtresave të sipërme (L1 dhe L2) në zinxhirin HO nëntokësor të sipërfaqes bazale të akullit gjashtëkëndor. Lidhjet e miratuara të hidrogjenit në shtresat e sipërme të gjashtëkëndëshave (L1 O ··· HO L2) janë më të forta se ato të pranuara në shtresën e dytë në akumulimin e sipërm (L1 OH ··· O L2). Ofrohen struktura interaktive gjashtëkëndore akulli.
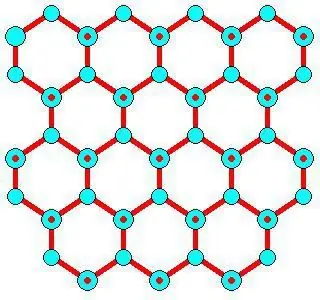
Veçoritë e zhvillimit
Numri minimal i molekulave të ujit që nevojiten për të formuar akullin është afërsisht 275 ± 25, si për një grup të plotë ikozaedral prej 280. Formimi ndodh me një shpejtësi prej 10 10 në ndërfaqe ajër-ujë dhe jo në ujë me shumicë. Rritja e kristaleve të akullit varet nga ritme të ndryshme rritjeje të ndryshmeenergjitë. Uji duhet të mbrohet nga ngrirja gjatë kriopservimit të mostrave biologjike, ushqimit dhe organeve.
Kjo zakonisht arrihet me ritme të shpejta ftohjeje, duke përdorur mostra të vogla dhe një kriokonservator, dhe duke rritur presionin për të bërë bërthamën e akullit dhe për të parandaluar dëmtimin e qelizave. Energjia e lirë e akullit/lëngjit rritet nga ~30 mJ/m2 në presionin atmosferik në 40 mJ/m-2 në 200 MPa, që tregon arsyeja pse ndodh ky efekt.
Çfarë lloji i rrjetës kristalore është karakteristik për akullin
Përndryshe, ato mund të rriten më shpejt nga sipërfaqet e prizmit (S2), në sipërfaqen e trazuar rastësisht të liqeneve të ngrirë shpejt ose të trazuar. Rritja nga fytyrat {1 1 -2 0} është të paktën e njëjtë, por i kthen ato në baza prizmi. Të dhënat mbi zhvillimin e kristalit të akullit janë hetuar plotësisht. Normat relative të rritjes së elementeve të fytyrave të ndryshme varen nga aftësia për të formuar një shkallë të madhe hidratimi të kyçeve. Temperatura (e ulët) e ujit përreth përcakton shkallën e degëzimit në kristalin e akullit. Rritja e grimcave kufizohet nga shkalla e difuzionit në një shkallë të ulët superftohjeje, pra <2 ° C, duke rezultuar në më shumë prej tyre.

Por i kufizuar nga kinetika e zhvillimit në nivele më të larta të depresionit prej >4°C, duke rezultuar në rritje me gjilpërë. Kjo formë është e ngjashme me strukturën e akullit të thatë (ka një rrjetë kristali me strukturë gjashtëkëndore), të ndryshmekarakteristikat e zhvillimit të sipërfaqes dhe temperaturës së ujit rrethues (superftohur), i cili qëndron pas formave të sheshta të borës.
Formimi i akullit në atmosferë ndikon thellësisht në formimin dhe vetitë e reve. Feldspatët, të gjetur në pluhurin e shkretëtirës që hyn në atmosferë në miliona tonë në vit, janë formues të rëndësishëm. Simulimet kompjuterike kanë treguar se kjo është për shkak të bërthamës së aeroplanëve prizmatikë të kristalit të akullit në plane sipërfaqësore me energji të lartë.
Disa elementë dhe grilë të tjerë
Substancat e tretura (me përjashtim të heliumit dhe hidrogjenit shumë të vogël, të cilët mund të hyjnë në interstiksione) nuk mund të përfshihen në strukturën Ih në presionin atmosferik, por detyrohen të dalin në sipërfaqe ose në shtresën amorfe midis grimcave të trup mikrokristalor. Ka disa elementë të tjerë në vendet e rrjetës së akullit të thatë: jonet kaotropike si NH4 + dhe Cl - të cilat përfshihen në ngrirjen e lëngshme më të lehtë se ato të tjera kozmotropike si Na + dhe SO42-, kështu që heqja e tyre nuk është e mundur për faktin se ato formojnë një shtresë të hollë të lëngut të mbetur midis kristaleve. Kjo mund të çojë në ngarkim elektrike të sipërfaqes për shkak të shpërbërjes së ujit sipërfaqësor duke balancuar ngarkesat e mbetura (që mund të çojë gjithashtu në rrezatim magnetik) dhe një ndryshim në pH të filmave të lëngshëm të mbetur, p.sh. NH 42SO4 bëhet më acid dhe NaCl bëhet më bazë.
Janë pingul me fytyratrrjetë kristalore akulli që tregon shtresën tjetër të ngjitur (me atome O në të zezë). Ato karakterizohen nga një sipërfaqe bazale me rritje të ngad altë {0 0 0 1}, ku janë ngjitur vetëm molekula të izoluara të ujit. Një sipërfaqe me rritje të shpejtë {1 0 -1 0} e një prizmi ku çiftet e grimcave të sapo ngjitura mund të lidhen me njëra-tjetrën me hidrogjen (një lidhje hidrogjeni/dy molekula të një elementi). Fytyra me rritje më të shpejtë është {1 1 -2 0} (prizmatike dytësore), ku zinxhirët e grimcave të sapo ngjitura mund të ndërveprojnë me njëra-tjetrën me lidhje hidrogjenore. Një nga zinxhirët/molekula e elementit të saj është një formë që formon kreshta që ndajnë dhe inkurajojnë transformimin në dy anët e prizmit.
Entropi me pikë zero
Mund të përkufizohet si S 0=k B ˣ Ln (N E0), ku k B është konstanta e Boltzmann-it, NE është numri i konfigurimeve në energjinë E dhe E0 është energjia më e ulët. Kjo vlerë për entropinë e akullit gjashtëkëndor në zero Kelvin nuk shkel ligjin e tretë të termodinamikës "Entropia e një kristali ideal në zero absolute është saktësisht zero", pasi këta elementë dhe grimca nuk janë ideale, kanë lidhje të çrregullt hidrogjenore.
Në këtë trup, lidhja e hidrogjenit është e rastësishme dhe ndryshon me shpejtësi. Këto struktura nuk janë saktësisht të barabarta në energji, por shtrihen në një numër shumë të madh të gjendjeve energjikisht të afërta, i binden "rregullave të akullit". Entropia e pikës zero është çrregullimi që do të mbetej edhe nëse materiali mund të ftohet në absolutzero (0 K=-273, 15 ° C). Gjeneron konfuzion eksperimental për akullin gjashtëkëndor 3, 41 (± 0, 2) ˣ mol -1 ˣ K -1. Teorikisht, do të ishte e mundur të llogaritet entropia zero e kristaleve të njohura të akullit me saktësi shumë më të madhe (duke neglizhuar defektet dhe përhapjen e nivelit të energjisë) sesa të përcaktohet në mënyrë eksperimentale.
Shkencëtarët dhe puna e tyre në këtë fushë
Mund të përkufizohet si S 0=k B ˣ Ln (N E0), ku k B është konstanta e Boltzmann-it, NE është numri i konfigurimeve në energjinë E dhe E0 është energjia më e ulët. Kjo vlerë për entropinë e akullit gjashtëkëndor në zero Kelvin nuk shkel ligjin e tretë të termodinamikës "Entropia e një kristali ideal në zero absolute është saktësisht zero", pasi këta elementë dhe grimca nuk janë ideale, kanë lidhje të çrregullt hidrogjenore.
Në këtë trup, lidhja e hidrogjenit është e rastësishme dhe ndryshon me shpejtësi. Këto struktura nuk janë saktësisht të barabarta në energji, por shtrihen në një numër shumë të madh të gjendjeve energjikisht të afërta, i binden "rregullave të akullit". Entropia e pikës zero është çrregullimi që do të mbetej edhe nëse materiali mund të ftohet në zero absolute (0 K=-273,15°C). Gjeneron konfuzion eksperimental për akullin gjashtëkëndor 3, 41 (± 0, 2) ˣ mol -1 ˣ K -1. Teorikisht, do të ishte e mundur të llogaritet entropia zero e kristaleve të njohura të akullit me saktësi shumë më të madhe (duke neglizhuar defektet dhe përhapjen e nivelit të energjisë) sesa të përcaktohet në mënyrë eksperimentale.

Megjithëse rendi i protoneve në akullin me shumicë nuk është i renditur, sipërfaqja ndoshta preferon rendin e këtyre grimcave në formën e brezave të atomeve H të varura dhe çifteve O-të vetme (entropia zero me lidhje hidrogjenore të renditura). Është gjetur çrregullimi i pikës zero ZPE, J ˣ mol -1 ˣ K -1 dhe të tjera. Nga të gjitha sa më sipër, është e qartë dhe e kuptueshme se cilat lloje të grilave kristal janë karakteristike për akullin.






