Një seksion i rëndësishëm i termodinamikës është studimi i transformimeve ndërmjet fazave të ndryshme të një substance, pasi këto procese ndodhin në praktikë dhe kanë një rëndësi thelbësore për parashikimin e sjelljes së një sistemi në kushte të caktuara. Këto transformime quhen tranzicione fazore, të cilave i kushtohet artikulli.
Koncepti i një faze dhe një komponenti sistemi

Para se të vazhdohet me shqyrtimin e tranzicioneve fazore në fizikë, është e nevojshme të përcaktohet koncepti i vetë fazës. Siç dihet nga kursi i fizikës së përgjithshme, ekzistojnë tre gjendje të materies: e gaztë, e ngurtë dhe e lëngët. Në një pjesë të veçantë të shkencës - në termodinamikë - ligjet formulohen për fazat e materies, dhe jo për gjendjet e tyre të grumbullimit. Një fazë kuptohet si një vëllim i caktuar lënde që ka një strukturë homogjene, karakterizohet nga veti specifike fizike dhe kimike dhe ndahet nga pjesa tjetër e materies me kufij, të cilët quhen ndërfazë.
Kështu, koncepti i "fazës" mbart informacion praktikisht shumë më domethënës për pronatmateria sesa gjendja e saj e grumbullimit. Për shembull, gjendja e ngurtë e një metali si hekuri mund të jetë në fazat e mëposhtme: kubik magnetik në qendër të trupit me temperaturë të ulët (BCC), bcc jomagnetike me temperaturë të ulët, kub me qendër fytyrën (fcc) dhe të lartë temperaturë jomagnetike bcc.
Përveç konceptit të "fazës", ligjet e termodinamikës përdorin edhe termin "përbërës", që nënkupton numrin e elementeve kimike që përbëjnë një sistem të caktuar. Kjo do të thotë që faza mund të jetë ose monokomponente (1 element kimik) ose shumëkomponent (disa elementë kimikë).
Teorema e Gibbs dhe ekuilibri midis fazave të sistemit

Për të kuptuar tranzicionet fazore, është e nevojshme të njihen kushtet e ekuilibrit midis tyre. Këto kushte mund të përftohen matematikisht duke zgjidhur sistemin e ekuacioneve Gibbs për secilën prej tyre, duke supozuar se gjendja e ekuilibrit arrihet kur energjia totale Gibbs e sistemit e izoluar nga ndikimi i jashtëm pushon së ndryshuari.
Si rezultat i zgjidhjes së sistemit të treguar të ekuacioneve, krijohen kushte për ekzistencën e ekuilibrit midis disa fazave: një sistem i izoluar do të pushojë së evoluuari vetëm kur presionet, potencialet kimike të secilit komponent dhe temperaturat në të gjitha fazat. janë të barabartë me njëri-tjetrin.
Rregulli i fazës Gibbs për ekuilibrin

Një sistem i përbërë nga disa faza dhe komponentë mund të jetë në ekuilibër jo vetëmnë kushte të caktuara, për shembull, në një temperaturë dhe presion specifik. Disa nga variablat në teoremën e Gibbs-it për ekuilibrin mund të ndryshohen duke ruajtur si numrin e fazave ashtu edhe numrin e komponentëve që janë në këtë ekuilibër. Numri i variablave që mund të ndryshohen pa prishur ekuilibrin në sistem quhet numri i lirive të këtij sistemi.
Numri i lirive l të një sistemi të përbërë nga f faza dhe k komponentë përcaktohet në mënyrë unike nga rregulli i fazës Gibbs. Ky rregull shkruhet matematikisht si më poshtë: l + f=k + 2. Si të punohet me këtë rregull? Shume e thjeshte. Për shembull, dihet se sistemi përbëhet nga f=3 faza ekuilibri. Cili është numri minimal i komponentëve që mund të përmbajë një sistem i tillë? Ju mund t'i përgjigjeni pyetjes duke arsyetuar si më poshtë: në rastin e ekuilibrit, kushtet më të rrepta ekzistojnë kur ai realizohet vetëm në tregues të caktuar, domethënë një ndryshim në çdo parametër termodinamik do të çojë në çekuilibër. Kjo do të thotë se numri i lirive l=0. Duke zëvendësuar vlerat e njohura të l dhe f, marrim k=1, domethënë një sistem në të cilin tre faza janë në ekuilibër mund të përbëhet nga një komponent. Një shembull kryesor është pika e trefishtë e ujit, ku akulli, uji i lëngshëm dhe avulli ekzistojnë në ekuilibër në temperatura dhe presione specifike.
Klasifikimi i transformimeve fazore
Nëse filloni të ndryshoni disa parametra termodinamikë në një sistem në ekuilibër, mund të vëzhgoni se si një fazë do të zhduket dhe një tjetër do të shfaqet. Një shembull i thjeshtë i këtij procesi është shkrirja e akullit kur nxehet.
Duke pasur parasysh që ekuacioni Gibbs varet vetëm nga dy variabla (presioni dhe temperatura), dhe tranzicioni fazor përfshin një ndryshim në këto variabla, atëherë matematikisht kalimi ndërmjet fazave mund të përshkruhet duke diferencuar energjinë Gibbs në lidhje me variablat. Ishte kjo qasje që u përdor nga fizikani austriak Paul Ehrenfest në 1933, kur ai përpiloi një klasifikim të të gjitha proceseve të njohura termodinamike që ndodhin me një ndryshim në ekuilibrin fazor.
Nga bazat e termodinamikës rrjedh se derivati i parë i energjisë Gibbs në lidhje me temperaturën është i barabartë me ndryshimin e entropisë së sistemit. Derivati i energjisë Gibbs në lidhje me presionin është i barabartë me ndryshimin e vëllimit. Nëse, kur fazat në sistem ndryshojnë, entropia ose vëllimi pësojnë një ndërprerje, domethënë ndryshojnë papritur, atëherë ato flasin për një tranzicion fazor të rendit të parë.
Më tej, derivatet e dytë të energjisë Gibbs në lidhje me temperaturën dhe presionin janë kapaciteti i nxehtësisë dhe koeficienti i zgjerimit vëllimor, përkatësisht. Nëse transformimi ndërmjet fazave shoqërohet nga një ndërprerje në vlerat e sasive fizike të treguara, atëherë flitet për një tranzicion fazor të rendit të dytë.
Shembuj të transformimeve ndërmjet fazave

Ka një numër të madh të tranzicioneve të ndryshme në natyrë. Në kuadrin e këtij klasifikimi, shembuj të mrekullueshëm të tranzicioneve të llojit të parë janë proceset e shkrirjes së metaleve ose kondensimi i avullit të ujit nga ajri, kur ka një kërcim vëllimi në sistem.
Nëse flasim për tranzicione të rendit të dytë, atëherë shembuj të mrekullueshëm janë shndërrimi i hekurit nga një gjendje magnetike në një gjendje paramagnetike në një temperaturë768 ºC ose shndërrimi i një përcjellësi metalik në një gjendje superpërcjellëse në temperatura afër zeros absolute.
Ekuacione që përshkruajnë tranzicione të llojit të parë
Në praktikë, shpesh është e nevojshme të dihet se si temperatura, presioni dhe energjia e absorbuar (liruar) ndryshojnë në një sistem kur ndodhin transformime fazore në të. Për këtë qëllim përdoren dy ekuacione të rëndësishme. Ato janë marrë në bazë të njohurive të bazave të termodinamikës:
- Formula e Clapeyron, e cila vendos marrëdhënien midis presionit dhe temperaturës gjatë transformimeve midis fazave të ndryshme.
- Formula Clausius që lidh energjinë e përthithur (të çliruar) dhe temperaturën e sistemit gjatë transformimit.
Përdorimi i të dy ekuacioneve nuk është vetëm në marrjen e varësive sasiore të sasive fizike, por edhe në përcaktimin e shenjës së pjerrësisë së kurbave të ekuilibrit në diagramet fazore.
Ekuacion për përshkrimin e tranzicioneve të llojit të dytë

Tranzicionet fazore të llojit 1 dhe 2 përshkruhen nga ekuacione të ndryshme, pasi aplikimi i ekuacioneve Clausius dhe Clausius për tranzicionet e rendit të dytë çon në pasiguri matematikore.
Për të përshkruar këtë të fundit, përdoren ekuacionet Ehrenfest, të cilat vendosin një marrëdhënie midis ndryshimeve të presionit dhe temperaturës nëpërmjet njohjes së ndryshimeve në kapacitetin termik dhe koeficientit të zgjerimit vëllimor gjatë procesit të transformimit. Ekuacionet Ehrenfest përdoren për të përshkruar tranzicionet përcjellës-mbipërçues në mungesë të një fushe magnetike.
Rëndësiadiagramet fazore
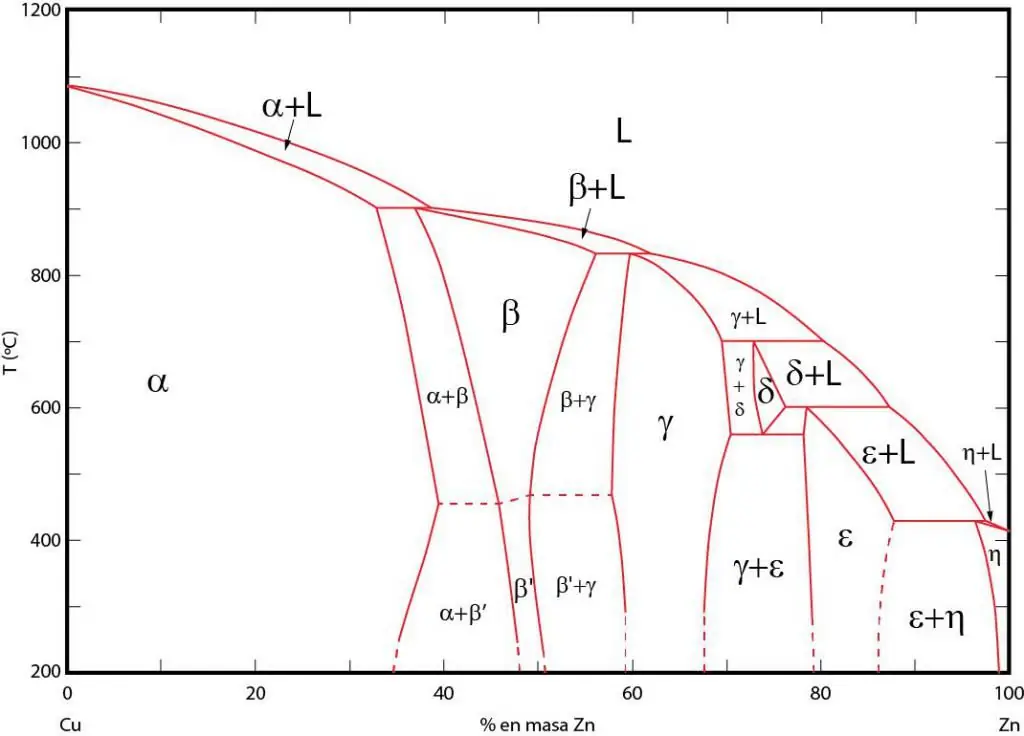
Diagramet e fazave janë një paraqitje grafike e zonave në të cilat fazat përkatëse ekzistojnë në ekuilibër. Këto zona ndahen me linja ekuilibri midis fazave. Shpesh përdoren diagramet fazore P-T (presion-temperaturë), T-V (temperaturë-vëllim) dhe P-V (presion-vëllim).
Rëndësia e diagrameve fazore qëndron në faktin se ato ju lejojnë të parashikoni se në cilën fazë do të jetë sistemi kur kushtet e jashtme ndryshojnë në përputhje me rrethanat. Ky informacion përdoret në trajtimin termik të materialeve të ndryshme për të marrë një strukturë me vetitë e dëshiruara.






